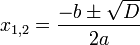Chemický vzorec
Chemický vzorec je grafické zobrazení složení, případně struktury a prostorového uspořádání molekul chemické sloučeniny nebo prvku za použití symbolů prvků, případně čísel a dalších znaků (např. závorek) a grafických prvků (čar a křivek). Pod pojmem chemický vzorec se může skrývat řada různých reprezentací molekul. Česká terminologie označování jednotlivých kategorií chemických vzorců není zcela ustálená.
Stechiometrický vzorec
Stechiometrický vzorec zaznamenává složení chemické sloučeniny bez ohledu na skutečný počet atomů v molekule. Zapisuje se jako řada symbolů prvků obsažených v dané sloučenině, případně doplněných číselnými indexy, umisťovanými vpravo dole za symbolem určitého prvku. Symbol každého z těchto prvků se vyskytne ve stechiometrickém vzorci právě jednou. Chceme-li zdůraznit, že se jedná o stechiometrický vzorec, uzavřeme jeho zápis do složených závorek { }. Přitom pořadí zápisu symbolu prvků ve vzorci není podstatné, někdy se řadí abecedně, jindy podle vzrůstajícího protonového (atomového) čísla. Nejčastější praxe je u anorganických sloučenin taková, že se prvky ve vzorci řadí v pořadí kovy v pořadí vzrůstajících protonových čísel-vodík-významný (charakteristický) nekov-ostatní prvky v pořadí vzrůstajících protonových čísel. U organických sloučenin se obvykle řadí v pořadí uhlík-vodík-ostatní prvky v pořadí vzrůstajících protonových čísel. Číselné indexy u symbolů prvků vyjadřují relativní poměr jednotlivých atomů prvků v dané chemické sloučenině, nikoli nezbytně skutečný počet atomů v molekule. Tento způsob zápisu se nejčastěji používá u iontových sloučenin, u kterých vlastně molekuly neexistují; v pevné krystalické fázi nelze rozlišit příslušnost jednotlivých iontů k hypotetické molekule a v roztocích existují samostatné (případně solvatované) ionty.
Příkladem stechiometrického vzorce u iontových sloučenin může být:
- chlorid sodný – NaCl resp. {NaCl}
- síran amonný – H8N2O4S resp. {H8N2O4S}
- dusičnan draselný – KNO3 resp. {KNO3}
- dusičnan amonný – H4N2O3 resp. {H4N2O3}
U neiontových sloučenin se stechiometrické vzorce používají výjimečně, prakticky jen v případech, kdy neznáme u sloučeniny její molekulovou hmotnost. Pokud byl takový vzorec stanoven na základě chemické kvantitativní analýzy, pak většinou hovoříme o empirickém stechiometrickém vzorci nebo krátce o empirickém vzorci.
Příkladem stechiometrického vzorce u neiontových sloučenin může být:
- oxid dusičitý – {NO2} – počet atomů odpovídá jedné molekule monomerni formy, resp. polovině molekuly dimerní formy této sloučeniny
- methan – {CH4} – počet atomů odpovídá jedné molekule
- ethan – {CH3} – počet atomů odpovídá jedné polovině molekuly
- benzen – {CH} – počet atomů odpovídá jedné šestině molekuly
- glukosa – {CH2O} – počet atomů odpovídá jedné šestině molekuly